Étiquetage pharmaceutique est un aspect crucial de l’industrie pharmaceutique, servant de principal canal de communication entre les fabricants de médicaments et les utilisateurs finaux. Il fournit des informations essentielles sur l’identification, la posologie, l’administration et la sécurité des médicaments.
Les organismes de réglementation du monde entier, tels que la FDA aux États-Unis et l’EMA en Europe, imposent des exigences strictes pour garantir que chaque étiquette sur les produits pharmaceutiques est exacte, informative et conforme aux normes locales et internationales.
Réglementation mondiale
- États-Unis (réglementations de la FDA) : Aux États-Unis, la Food and Drug Administration (FDA) impose un étiquetage complet comprenant le nom du médicament, la forme posologique, la quantité nette, les ingrédients actifs et la voie d’administration. La FDA exige également des avertissements spécifiques, des informations sur les interactions médicamenteuses et des symboles de substances contrôlées, le cas échéant. De plus, l’étiquetage doit être conçu pour répondre aux normes de lisibilité afin de garantir qu’il soit accessible à tous les utilisateurs.
- Union européenne (réglementation EMA) : L’Agence européenne des médicaments (EMA) supervise les exigences d’étiquetage dans l’UE, qui comprennent des instructions détaillées dans toutes les langues officielles de l’Union européenne, en fonction des pays où le médicament est commercialisé. Les directives de l’EMA se concentrent sur la sécurité des patients en exigeant de la clarté dans l’étiquetage, y compris des instructions explicites sur l’utilisation et les effets secondaires potentiels du médicament.
- Chine (réglementations NMPA) : L’Administration nationale des produits médicaux (NMPA) exige que les étiquettes pharmaceutiques en Chine incluent à la fois les noms génériques et de marque du médicament, des informations complètes sur la posologie et les détails de fabrication. Les étiquettes doivent être en mandarin et doivent indiquer clairement les conditions particulières de stockage et les dates de péremption afin de maintenir l’efficacité et la sécurité du produit.
- Inde (réglementation CDSCO) : La Central Drugs Standard Control Organization (CDSCO) en Inde met l’accent à la fois sur la teneur en ingrédients pharmaceutiques actifs et sur les informations fournies par le fabricant sur les étiquettes des médicaments. Les étiquettes doivent fournir des instructions détaillées sur la posologie, les contre-indications et la catégorie légale du médicament (par exemple, sur ordonnance uniquement ou en vente libre).
Notre étiqueteuses répondent à tous ces critères et disposent d’une gamme de solutions, comme solution d’étiquetage de flacons et solution d’étiquetage pour seringues, etc.
Éléments clés de la réglementation en matière d’étiquetage
Les réglementations en matière d’étiquetage dans le secteur pharmaceutique visent principalement à garantir la sécurité des patients et à faciliter le bon usage des médicaments. Les éléments importants comprennent :
- Identification du médicament : Identification claire du médicament, y compris ses noms génériques et de marque.
- Informations posologiques : Instructions détaillées sur la posologie, les méthodes d’administration et la fréquence.
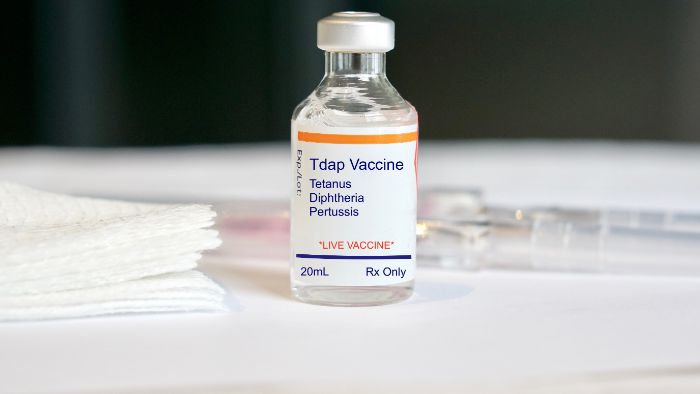
- Dates de fabrication et de péremption : Indispensable pour déterminer la durée de conservation du médicament.
- Liste des ingrédients : Tous les ingrédients actifs et inactifs doivent être répertoriés pour informer les utilisateurs des allergènes potentiels ou des sensibilités chimiques.

Instructions d’utilisation et avertissements : Des directives complètes sur la façon d’utiliser le médicament, y compris des avertissements et des effets secondaires possibles, pour prévenir une mauvaise utilisation et informer sur les risques potentiels.
Exigences particulières en matière d’étiquetage
Certains produits pharmaceutiques nécessitent des considérations supplémentaires en matière d’étiquetage :
- Substances contrôlées: Des fonctionnalités de sécurité supplémentaires telles que des conceptions inviolables et des mesures de traçabilité.
- Médicaments orphelins et autorisation d’utilisation d’urgence : Un étiquetage spécial qui traite des aspects uniques de ces médicaments, y compris un accès élargi et des instructions d’utilisation compassionnelle.
Durabilité et réglementation environnementale
L’évolution vers des pratiques durables a également eu un impact sur l’étiquetage pharmaceutique :
- Matériaux écologiques : Encourager l’utilisation de matériaux recyclés ou biodégradables pour les étiquettes pharmaceutiques.
- Recyclage et gestion des déchets : Les étiquettes doivent fournir des informations sur l’élimination et le recyclage appropriés des emballages pharmaceutiques.
Processus de conformité réglementaire et d’approbation des étiquettes
Les sociétés pharmaceutiques doivent naviguer dans des paysages réglementaires complexes pour assurer la conformité des étiquettes :
- Soumission de la conception d’une étiquette : Les étiquettes doivent être soumises aux autorités réglementaires pour approbation avant qu’un médicament puisse être commercialisé.
- Modification et réapprobation de l’étiquette : Toute modification apportée à l’étiquetage doit être soumise à nouveau et approuvée, garantissant que toutes les informations restent à jour et conformes.
Le rôle de la technologie dans la conformité
Les progrès technologiques facilitent le respect des réglementations en matière d’étiquetage :
- Systèmes d’étiquetage automatisés : Améliorez la précision et l’efficacité des applications d’étiquettes.
- Logiciel de gestion d’étiquettes : Aide à gérer la conception des étiquettes, les modifications et la documentation de conformité.

Conclusion
Étiquetage pharmaceutique n’est pas seulement une exigence réglementaire mais un outil essentiel pour garantir la sécurité et l’efficacité des produits pharmaceutiques. En adhérant aux directives établies par divers organismes de réglementation mondiaux, les fabricants peuvent garantir que leurs produits sont utilisés de manière sûre et efficace.
L’évolution continue des normes d’étiquetage exige une vigilance et une adaptation continues de la part de toutes les parties prenantes de l’industrie pharmaceutique afin de respecter les normes de soins et de sécurité des patients.
